Das Spektrum
der Sonne
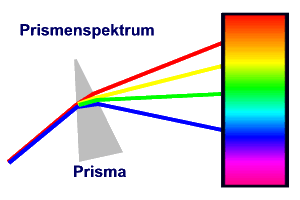
Das Licht einer Lichtquelle kann durch Brechung
an einem Prisma oder durch Beugung an einem optischen Gitter in ein Spektrum mit seinen
Spektrallinien aufgespalten werden.
Versuche: Spektrum einer Glühlampe, der
Natriumdampflampe, der Hg-Lampe und der Balmerlampe mit Gitter bzw. Prisma
Ergebnisse: Das Spektrum eines glühenden, festen Körpers (Glühlampe)
ist kontinuierlich von IR über rot, gelb, grün, blau zu UV.
Leuchtende
Gase ergeben ein Linienspektren.
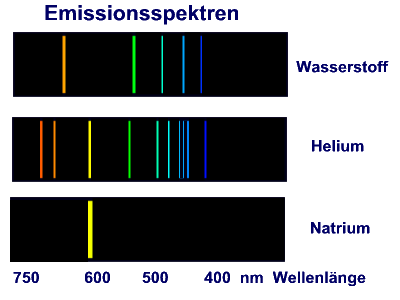
Die Spektrallinien sind typisch für das Element.
An Hand des Linienspektrums kann man auf den leuchtenden Stoff schließen, auch
auf Konzentration. Diese Beobachtungen bilden wesentliche Grundlagen der
Spektroskopie. Die Spektroskopie ist ein sehr bedeutendes Hilfsmittel, um
Informationen (Chemische Elemente, Temperaturen, Dichte, Geschwindigkeiten...)
über Sterne zu sammeln.
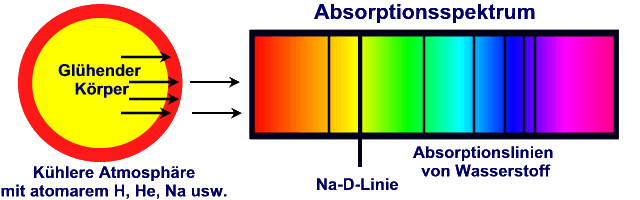
Aus dem Kontinuum werden also ganz bestimmte Wellenlängen ausgefiltert. Aus
der Analyse der Fraunhoferschen Linien zeigt sich, dass auf der Sonne dieselben
chemischen Elemente vorkommen wie auf der Erde. Allerdings in anderen
prozentualen Anteilen. Häufigstes Element ist Wasserstoff, gefolgt von Helium.
Diese Elemente machen 98% der Photosphärenmasse aus.
Aus
der Analyse der Fraunhoferschen Linien zeigt sich, dass auf der Sonne dieselben
chemischen Elemente vorkommen wie auf der Erde. Allerdings in anderen
prozentualen Anteilen. Häufigstes Element ist Wasserstoff, gefolgt von Helium.
Diese Elemente machen 98% der Photosphärenmasse aus.
Versuch: Betrachtung des Sonnenspektrums mit einem
Taschenspektrometer

Das
Spektrum des Wasserstoffatoms
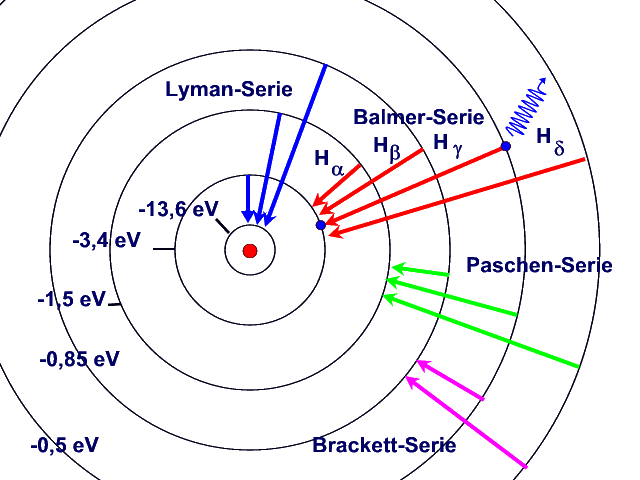
Balmer hat für die Wellenlängen der
Spektrallinien des Wasserstoffs im sichtbaren Bereich Term angegeben, die auf
ein einfaches Bildungsgesetz und auf diskrete Energieniveaus im Wasserstoffatom
hindeuten. Später konnten auch im UV und IR Spektrallinien gefunden werden, die
den gleichen Gesetzen folgen. Daraus entwickelte sich das Bohrsche
Atommodell.
Linienspektren - Das
Bohrsche Atommodell
Grundlagen
des Bohrschen Atommodells:
Elektronen können
nur auf ganz bestimmten Bahnen (Schalen) existieren:
Zu jeder Bahn gehört ein bestimmtes Energieniveau des Atoms (diskrete Energien)
Springt ein Elektron von einer höheren Bahn in eine niedrigere (Quantensprung), so emittiert das Atom Energie (--Spektrallinie)
Ein Elektron kann nur in eine höhere Bahn springen, wenn die Absorption eines Photons genau passender Energie erfolgt: Spektrallinie im Absorptionsspektrum
Für alle Elemente lassen sich Energieniveauschemen
angeben. Aus diesen sind ersichtlich, welche Spektrallinien zu erwarten sind. Für
das Wasserstoffatom und einige andere Atome können die Energieniveaus
„einfach“ berechnet werden.
|
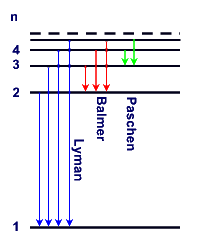
Spektralserien des
Wasserstoffatoms: Die Energieniveaus sind auf Bahn 1 bezogen.
Energieniveaus
und Übergänge können auch in einem Energieniveauschema dargestellt werden.
Beim H-Atom sind Übergänge in Absorption und Emission von allen angeregten
Zuständen ins Grundniveau und umgekehrt möglich.. Die Emissionsübergänge in
gleiche Niveaus, z.B. in das 2. Niveau, führen zu den Spektralserien, z.B. der
Balmerserie. |
 |
Das
Spektrum der Natriumdampflampe besteht im sichtbaren Bereich aus einer
intensiven Linie, der Natrium-D-Linie mit 568 nm im gelben Bereich. Wie aus dem
Termschema zu erkennen ist, liegen die anderen Übergänge im Bereich des IR
oder UV.
Bei Atomen sind normalerweise nicht alle denkbaren
Übergänge erlaubt, es gibt Auswahlregeln, die nur die beobachteten Übergänge
zulassen und andere ausschließen.
Helium zeigt ebenfalls Serien.
Betrachtet man das He-Ion He+ als ein dem Wasserstoff ähnliches
Atom, aber doppelter Kernladung, so erwartet ,man auch ähnliche Serien. Die
Pickeringserie des He+ und die Balmerserie des H ergeben auch
Spektrallinien, die nahezu übereinstimmen, es treten aber auch weitere Linie
auf, deren Erklärung einfach erfolgt.
Aus der Kenntnis der Spektren, die im Labor
untersucht worden sind, lässt sich ermitteln, welche Elemente in welcher
Konzentration in Sternen zu finden sind.